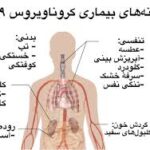
اتم
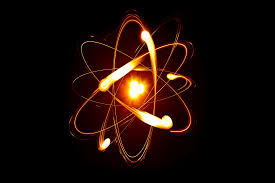
اَتُم (به فرانسوی: Atome) کوچکترین واحد تشکیل دهنده یک مادهٔ ساده است و خواصی مشابه آن ماده دارد که میتواند به کمک پیوند شیمیایی به اتمی دیگر متصل گردد.[۱] تئوری اتم گرایی که از عقیدهٔ تشکیل مواد از ریزدانههای نادیدنی (در برابر عقیده به تفکیکپذیر بودن مواد تا بی نهایت) دفاع میکرد از تاریخ باستان شناخته شده بود.
اتم ابتدا توسط دانشمند ایرانی هوشتانه (به یونانی اوستن یا اوستانوس) که در لشکرکشی خشایارشاه به یونان با او همراه بود و در آنجا به آموزش کیمیا میپرداخت طرح گردید.[۲] مکتب آموزشی او چنان مورد استقبال قرار گرفت که بنا به گفتهٔ پلینی(پلینیوس)، بسیاری از فیلسوفان یونان همچون فیثاغورث، امپدکلس، دموکریت، و افلاطون برای مطالعهٔ آن به خارج سفر کردند.[۳][۴] پس از او توسط شاگرد وی فلاسفهٔ یونان باستان از جمله لئوکیپوس و دموکریت، و همچنین بعدها در هند و در یکی از شش مدرسهٔ هندوئیسم یعنی وایشِشیکا که توسط کاناد بنیان نهاده شده بود، تدریس میشد.
اتم از یک هسته مرکزی با بار مثبت محاطه شده با ابر الکترونی با بار منفی تشکیل شدهاست. تعریف دیگری آن را به عنوان کوچکترین واحدی در نظر میگیرد که ماده را میتوان به آن تقسیم کرد بدون اینکه اجزاء بارداری از آن خارج شود.[۵] اتم ابری الکترونی، تشکیلشده از الکترونها با بار الکتریکی منفی، که هستهٔ اتم را احاطه کردهاست. هسته نیز خود از پروتون که دارای بار مثبت است و نوترون که از لحاظ الکتریکی خنثی است تشکیل شدهاست. زمانی که تعداد پروتونها و الکترونهای اتم با هم برابر هستند اتم از نظر الکتریکی در حالت خنثی یا متعادل قرار دارد در غیر این صورت آن را یون مینامند که میتواند دارای بار الکتریکی مثبت یا منفی باشد. اتمها با توجه به تعداد پروتونها و نوترونهای آنها طبقهبندی میشوند. تعداد پروتونهای اتم مشخصکننده نوع عنصر شیمیایی و تعداد نوترونها مشخصکننده ایزوتوپ عنصر است.[۶]
نظریه مکانیک کوانتومی تصویر پیچیدهای از اتم ارائه میدهد و این پیچیدگی دانشمندان را مجبور میکند که جهت توصیف خواص اتم بجای یک تصویر متوسل به تصاویر شهودی متفاوتی از اتم شوند. بعضی وقتها مناسب است که به الکترون به عنوان یک ذره متحرک به دور هسته نگاه کرد و گاهی مناسب است به آنها عنوان ذراتی که در امواجی با موقعیت ثابت در اطراف هسته (مدار: orbits) توزیع شدهاند نگاه کرد. ساختار مدارها تا حد بسیار زیادی روی رفتار اتم تأثیر گذارده و خواص شیمیایی یک ماده توسط نحوه دستهبندی این مدارها معین میشود.[۵]
اجزا
جهت بررسی اجزاء یک ماده، میتوان به صورت پی در پی آن را تقسیم کرد. اکثر مواد موجود در طبیعت ترکیب شلوغی از مولکولهای مختلف است. با تلاش نسبتاً کمی میتوان این مولکولها را از هم جدا کرد. مولکولها خودشان متشکل از اتمها هستند که توسط پیوندهای شیمیایی به هم پیوند خوردهاند. با مصرف انرژی بیشتری میتوان اتمها را از مولکولها جدا کرد. اتمها خود از اجزاء ریزتری بنام هسته و الکترون تشکیل شده که توسط نیروهای الکتریکی به هم پیوند خوردهاند و شکستن آنها انرژی بسی بیشتری طلب میکند. اگر سعی در شکستن این اجرا زیر اتمی با صرف انرژی زیاد بکنیم، کار ما باعث تولید شدن ذرات جدیدی میشویم که خیلی از آنها بار الکتریکی دارند.[۵] همانطور که اشاره شد اتم از هسته و الکترون تشکیل شدهاست. جرم اصلی اتم در هسته قرار دارد؛ فضای اطراف هسته عموماً فضای خالی میباشد. هسته خود از پروتون (که بار مثبت دارد)، و نوترون (که بار خنثی دارد) تشکیل شده. الکترون هم بار منفی دارد. این سه ذره عمری طولانی داشته و در تمامی اتمهای معمولی که به صورت طبیعی تشکیل میشوند یافت میشود. بجز این سه ذره، ذرات دیگری نیز در ارتباط با آنها ممکن است موجود باشد؛ میتوان این ذرات دیگر را با صرف انرژی زیاد نیز تولید کرد ولی عموماً این ذرات زندگی کوتاهی داشته و از بین میروند.[۵]
اتمها مستقل از اینکه چند الکترون داشته باشند (۳ تا ۹۰ تا)، همه تقریباً یک اندازه دارند. به صورت تقریبی اگر ۵۰ میلیون اتم را کنار هم روی یک خط بگذاریم، اندازه آن یک سانتیمتر میشود. به دلیل اندازه کوچک اتمها، آنها را با واحدی به نام آنگستروم که برابر ۱۰- ۱۰ متر است میسنجند.[۵]
ذرات زیراتمی
با وجود اینکه منظور از اتم ذرهای تجزیه ناپذیر بود، امروز میدانیم که اتم از ذرات کوچکتری تشکیل شدهاست. الکترونها، پروتونها و نوترونها ذرات تشکیل دهندهٔ اتم هستند. البته یون هیدروژن بدون الکترون و نیز بدون نوترون؛ هیدروژن +۱ است.
در مدل استاندارد، الکترونها ذرات بنیادی، هسته یعنی بدون ساختار داخلی، پنداشته میشوند؛ در حالی که پروتونها و نوترون از ذرات دیگری به نام کوارک تشکیل شدهاند.
هسته
هسته دارای نوترون و پروتون است. پروتون دارای بار مثبت (+) و نوترون بدون بار است؛ و در خارج از هسته الکترون وجود دارد که بار آن منفی(-)است.
ابر الکترونی
این مدل پیشنهاد شده توسط اروین شرودینگر و ایده چندین دانشمند و محقق در سال ۱۹۳۵ میباشد. در این مدل مانند مدل بور (منظومه شمسی) هسته عمده جرم اتم را تشکیل میدهد و در مرکز، الکترون با انرژی مختلف به دور هسته در گردش میباشد و الکترونها در لایهای با انرژی معینی وجود ندارند.
مدلهای اتمی
مدل اتمی دموکریت
دموکریت در ۵۰۰سال قبل از میلاد اوّلین تحقیقها را در رابطه با اتم انجام داد. البته تعداد اندکی از آزمایش های او مورد قبول واقع گردید اما اصلیترین گام در راستای تحقیق در رابطه با اتم بود. نام اتم به معنای تجزیه ناپذیر را نیز او انتخاب کرد. نظریههای او بسیار ابتدایی بود اما باید توجه داشت که تا زمانی که نمیتوان اتم را به چشم دید صحبت در رابطه با آن نیز تنها حدس است. او بر این عقیده بود که:
- ماده ساختار ذرّهای دارد یعنی از ذرّهها بسیار کوچکی ساخته شدهاست که خود آن را میتوان تجزیه ناپذیر نامید.
- اتم مواد مختلف در شکل بایکدیگر متفاوت است. برای مثال مواد تیز و برنده یا ترش دارای اتمی با لبههای تیز به شکلهایی چون مثلث هستند یا مواد نرم و شیرین دارای شکلی دایرهای است. (البته این مورد در نظرات بعدی کاملاً رد شده)
مدل اتمی دالتون
نظریهٔ اتمی دالتون: جان دالتون نظریه اتمی خود را با اجرای آزمایش در هفت بند بیان کرد.
- ماده از ذرههای تجزیه ناپذیری به نام اتم ساخته شدهاست.
- همهٔ اتمهای یک عنصر، مشابه یکدیگرند.
- اتمها نه به وجود میآیند و نه از بین میروند.
- همهٔ اتمهای یک عنصر جرم یکسان و خواص شیمیایی یکسان دارند.
- اتمهای عنصرهای مختلف به هم متصل میشوند و مولکولها را به وجود میآورند.
- در هر مولکول از یک ماده مرکب معین، همواره نوع و تعداد نسبی اتمهای سازنده ی آن یکسان است.
- واکنشهای شیمیایی شامل جابهجایی اتمها یا تغییر در شیوهٔ اتصال آنها است.
نظریههای دالتون نارساییها و ایرادهایی دارد و اما آغازی مهم بود. مواردی که نظریهٔ دالتون نمیتوانست توجیه کند:
- پدیدهٔ برقکافت (الکترولیز) و نتایج مربوط به آن
- پیوند یونی – فرق یون با اتم خنثی
- پرتو کاتدی
- پرتوزایی و واکنشهای هستهای
- مفهوم ظرفیت در عناصر گوناگون
- پدیدهٔ ایزوتوپی
قسمت اول نظریهٔ دالتون تأیید فیلسوف یونانی (دموکریت) بود.
نظریهٔ دالتون از سه قسمت اصلی (قانون بقای جرم – قانون نسبتها معین – قانون نسبتهای چندگانه) میباشد.
مطالعهٔ اتمها و ذرات ریزتر فقط به صورت غیرمستقیم و از روی رفتار (خواص) امکانپذیر است.
اولین ذرهٔ زیراتمی شناخته شده الکترون است. مواردی که به کشف و شناخت الکترون منجر شد:
- الکتریسیتهٔ ساکن یا مالشی
- پدیدهٔ الکترولیز (برقکافت)
- پرتو کاتدی
- ۴پدیدهٔ پرتوزایی
مدل اتمی جوزف تامسون
مدل اتمی تامسون (کیک کشمشی، مدل هندوانه ای )
- الکترون با بار منفی، درون فضای ابرگونه با بار مثبت، پراکنده شدهاند.
- اتم در مجموع خنثی است. مقدار بار مثبت با بار منفی برابر است.
- این ابر کروی مثبت، جرمی ندارد و جرم اتم به تعداد الکترون آن بستگی دارد.
- جرم زیاد اتم از وجود تعداد بسیار زیادی الکترون در آن ناشی میشود.
مدل اتمی ارنست رادرفورد
- هر اتم دارای یک هسته کوچک است که بیشتر جرم اتم در آن واقع است.
- هسته اتم دارای بار الکتریکی مثبت است.
- حجم هسته در مقایسه با حجم اتم بسیار کوچک است زیرا بیشتر حجم اتم را فضای خالی تشکیل میدهد.
- هسته اتم به وسیلهٔ الکترونها محاصره شدهاست.
مدل اتمی نیلز بور دانمارکی
او یکی از محققان موفق در این راه بود که با وجود اشتباه بودن مدل او بازهم در خیلی مکانها مانند انرژی اتمی از آن استفاده میشود.
- اتم دارای هسته کوچک اما سنگین با بار مثبت است.
- هسته در اتم در حجم کمی قرار دارد که اطراف آن الکترونها بر روی مدارهایی مانند منظومه شمسی به دور آن میچرخند.
اطلاعات جدیدی اضافه شد:
همچنین ایشان بر این باور بودند که الکترونها بر روی مدارهایی به دور هستهٔ اتم پیوسته در حال گردش اند و این نظریه علاوه بر نارسا بودن اطلاعات
سودمندی در رابطه با ساختار اتم میدهد، منظور از نارسا بودن این است که شکلهای الکترونها به صورت ناقص ترسیم شده میباشد در حالی که امروزه میدانیم
نظریه کامل تری با نام مد لایهای عرضه شدهاست.
مدل اتمی جیمز چادویک
قطعاً مدل اتمی بور با اشکال قابل توجهی روبرو بود و آن هم نبود نوترون یا مادهای بود که دافعهٔ بین پروتونها در مرکز هسته را از بین ببرد. از اینرو چادویک با تأکید بر درستی مدل منظومه شمسی نیلز بور، با توضیح وجود نوترون در هستهٔ اتم، ایراد آن را برطرف کرد. از آن به بعد اصلاحات دیگری بر روی توضیح هستهٔ اتم انجام نشدهاست. البته دانشمندان بزرگی همچون اروین شرودینگر، پس از او نظریات اتمی بسیاری ارائه کردهاند، ولی هنوز هم (در رابطه با هسته اتم)، کاملترین نظریه متعلق به جیمز چادویک است.
مدل اتمی شرود ینگر(لایهای)
یک مدل اتمی است که امروزه پذیرفته شدهاست ولی هنوز از مدل اتمی بور برای نمایش اتم استفاده میشود. در این مدل مانند مدل بور هسته که عمدهٔ جرم اتم را تشکیل داده در مرکز اتم قرار دارد و الکترونها با انرژیهای مختلف به دور هسته در حال گردش هستند. با این تفاوت که در این مدل الکترونها به شکل ابری که ابر الکترونی نامیده شدهاست در اطراف هسته اتم و در فضای بسیار بزرگی که قطر آن ۱۰۰۰۰ برابر قطر هستهٔ اتم است در حرکتند.
شنیده شدن صدای اتم
محققان دانشگاه صنعتی چالمرز سوئد برای نخستین بار از صوت برای برقراری ارتباط با یک اتم مصنوعی استفاده کردند. تعامل بین اتم و نور پدیدهای شناخته شدهاست و بهطور وسیعی در دانش کوانتومی به کار میرود، با این حال دستیابی به همان میزان تعامل با استفاده از امواج صوتی فرایندی چالش برانگیزتر است. هماکنون، محققان دانشگاه چالمرز موفق به جفت کردن امواج صوتی با یک اتم مصنوعی شدهاند و این موفقیت با همکاری فیزیکدانان نظری و تجربی حاصل شدهاست.
«پر دلسینگ»، رهبر تیم تحقیقاتی تجربی، در اینباره گفت: با صحبت کردن و گوش دادن به اتمها دریچه جدیدی را به جهان کوانتومی گشودهایم. هدف بلندمدت ما مهارکردن فیزیک کوانتومیاست بهطوری که بتوانیم از قوانین آن نهایت استفاده را بکنیم بهطور مثال، در ساخت رایانههای بینهایت پرسرعت بهکار ببریم. ما این کار را با خلق مدارهای الکتریکی انجام میدهیم که از قوانین کوانتومی تبعیت میکند.
وی ادامه داد: یک اتم مصنوعی مثالی از چنین مدار الکتریکی کوانتومی است و درست مانند یک اتم طبیعی میتوان آن را با انرژی شارژ کرد. این انرژی معمولاً در شکل یک ذره ساطع میشود که این ذره، معمولاً یک ذره نور است. با این حال، اتم موجود در آزمایش دانشمندان دانشگاه چالمرز برای ساطعکردن و جذبکردن انرژی در شکل صوت طراحی شده بود. جزئیات این موفقیت علمی در مجلهٔ ساینس منتشر شد.
ادعای دیده شدن اتم
به نوشتهٔ مجلهٔ ساینتیفیک امریکن (Scientific American) در سال ۲۰۰۹ ایگور میخائیلفسکی و همکارانش در آزمایشگاه فیزیک و فناوری اوکراین توانستند از یک اتم تصویر تهیه کنند. آنها از یک زنجیرهٔ اتم کربن در گرافیت کمک گرفتند و برای این کار از تکنیکی به نام میکروسکوپی تابش میدان بهره گرفتند.